Lista
de contenidos

Definición: 
¿Qué se entiende por solubilidad?
Las sustancias no se disuelven en igual medida en un mismo
disolvente. Con el fin de poder comparar la capacidad que tiene
un disolvente para disolver un producto dado, se utiliza una
magnitud que recibe el nombre de solubilidad. La capacidad de
una determinada cantidad de líquido para disolver una sustancia
sólida no es ilimitada. Añadiendo soluto a un volumen dado de
disolvente se llega a un punto a partir del cual la disolución
no admite más soluto (un exceso de soluto se depositaría en
el fondo del recipiente). Se dice entonces que está saturada.
Pues bien, la solubilidad de una sustancia respecto de un disolvente
determinado es la concentración que corresponde al estado de
saturación a una temperatura dada.
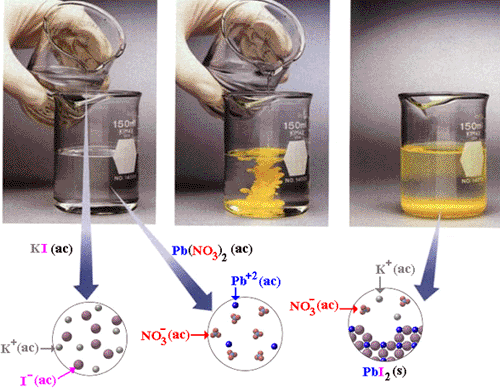
Químicamente: Las solubilidades de
sólidos en líquidos varían mucho de unos sistemas a otros. Así
a 20 ºC la solubilidad del cloruro de sodio (NaCl) en agua es
6 M y en alcohol etílico (C2H6O), a esa misma temperatura, es
0.009 M. Cuando la solubilidad es superior a 0,1 M se suele
considerar la sustancia como soluble en el disolvente considerado;
por debajo de 0,1 M se considera como poco soluble o incluso
como insoluble si se aleja bastante de este valor de referencia.
Físicamente: La solubilidad depende
de la temperatura; de ahí que su valor vaya siempre acompañado
de la temperatura de trabajo. En la mayor parte de los casos,
la solubilidad aumenta al aumentar la temperatura. Se trata
de procesos en los que el sistema absorbe calor para apoyar
con una cantidad de energía extra el fenómeno la solvatación.
En otros, sin embargo, la disolución va acompañada de una liberación
de calor y la solubilidad disminuye al aumentar la temperatura.
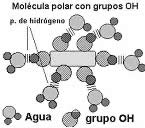
1.-Presentación gráfica de la solubilidad de moléculas inorgánicas
|