Numero atómico (Z).
Todos los átomos su pueden identificar por el numero de protones que contienen.
El Numero atómico Z, es el numero de protones en el núcleo del átomo
de un elemento. En un átomo neutro el número de protones es igual
al número de electrones, de manera que el número atómico
también indica el número de electrones presentes en un átomo.
La identidad química de un átomo queda determinada por su número
atómico. Por ejemplo el número del sodio (Na) es 11. Esto quiere
decir que cada átomo neutro de sodio tiene 11 protones y 11 electrones.
O también puede ser visto desde el punto de vista que cada átomo
en el universo que contenga 11 protones se llama “sodio”.
Masa atómica (A).
El número de masa es el número total de protones y neutrones presentes
en el núcleo de un átomo de un elemento. Existe un excepción
de la forma más común del hidrogeno, que tiene un protón
y no tiene neutrones, todos los núcleos atómicos contienen tanto
protones como neutrones. El número de masa esta dado por:
A= Z + Nº de N
Numero masico (A)= numero atómico (Z) + numero de neutrones (N)
Numero de masa = numero de protones + numero de neutrones.
La expresión dada es sirve para calcular tanto el numero de masa como
también el numero atómico.
El numero de neutrones en un átomo es igual a la diferencia entre el numero
de masa y el numero atómico (A-Z). Por ejemplo, el numero de masa del
fluor es 19 y su numero atómico es 9 lo que quiere decir que tiene 9 protones
en el núcleo. Así, el numero de neutrones en un átomo de
fluor es 19-9= 10.
El número atómico (Z) y el número de masa (A), se denotan
de la siguiente manera (X representa cualquier elemento):

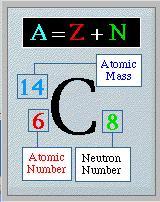
Imagen 3: la imagen nos representa de manera como identificar
el Z y A, de cada elemento.
Es importante mencionar que no todos los átomos de un elemento
determinado tienen la misma masa. La mayoría de los elementos
tienen dos o más isótopos, un isotopo es un átomo
que tiene el mismo número atómico pero diferente
número masico. Por ejemplos existen tres isótopos
del hidrogeno. (Ver imagen 3)
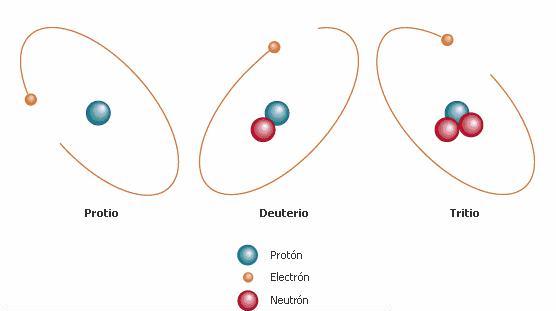
Imagen 4: Isótopos del hidrogeno.
El número de neutrones puede variar, lo que da lugar a isótopos
que tienen el mismo comportamiento químico pero diferente masa. Los isótopos
del hidrógeno son el protio (sin neutrones), el deuterio (un neutrón)
este isotopo es utilizado en reactores nucleares y en bombas atómicas.
Y el tritio (dos neutrones), carece las propiedades del las propiedades necesarias
para tales aplicaciones. El hidrogeno es el único que tiene un nombre
distinto para cada uno de sus isótopos, los isótopos de los demás
elementos como por ejemplo del uranio otro elemento con características
radiactivas sus isótopos se llaman uranio-235 y uranio-238.
Electronegatividad.
La electronegatividad es la capacidad de un átomo para atraer hacia
si los electrones de un enlace químico. Los valores de la electronegatividad
de los elementos representativos aumentan de izquierda a derecha en la tabla
periódica, a medida que aumenta el número de electrones de valencia
y disminuye el tamaño de los átomos. El flúor, de afinidad
electrónica muy elevada, y cuyos átomos son pequeños,
es el elemento más electronegativo y, en consecuencia, atrae a los electrones
muy fuertemente. Dentro de un grupo, la electronegatividad disminuye, generalmente,
al aumentar el número y el radio atómicos. El cesio, el elemento
representativo de mayor tamaño y de menor energía de ionización,
es el menos electronegativo de estos elementos. Un átomo electronegativo
tiende a tener una carga parcial negativa en un enlace covalente, o a formar
un ion negativo por ganancia de electrones. Dos átomos con electronegatividades
muy diferentes forman un enlace iónico. Pares de átomos con diferencias
pequeñas de electronegatividad forman enlaces covalentes polares con
la carga negativa en el átomo de mayor electronegatividad.
Los elementos con electronegatividad alta tienen más tendencia para
atraer electrones que los elementos con electronegatividad baja. La electronegatividad
se relaciona con la afinidad electrónica y la energía de ionización.
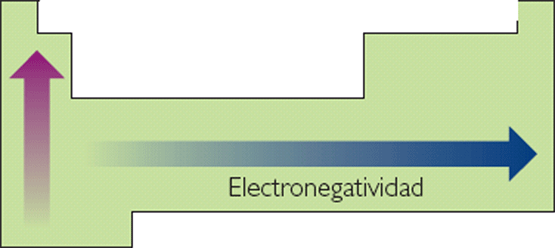
Imagen 5: electronegatividad de los elementos comunes.
Los valores de la electronegatividad de los elementos representativos
aumentan
de izquierda a derecha en la tabla periódica.
